- 010-68321050
- 搜索
- 企業(yè)郵箱
- 產(chǎn)品定制

專屬客服號(hào)

微信訂閱號(hào)
全面提升數(shù)據(jù)價(jià)值
賦能業(yè)務(wù)提質(zhì)增效
基因治療是將正常基因或帶有治療作用的基因通過一定方式導(dǎo)入人體,以糾正或補(bǔ)充基因缺陷及異常所帶來的疾病的治療方案。1972年,美國生物學(xué)家T. Friefman及R. Robin在《科學(xué)》雜志上發(fā)表文章《Gene therapy for human genetic disease?》,提出了基因療法用于遺傳疾病治療的假設(shè)。這一文章被廣泛認(rèn)為具有劃時(shí)代的前瞻性。此后伴隨一系列臨床試驗(yàn)的開展,基因治療的發(fā)展經(jīng)歷了“初期探索”、“狂熱發(fā)展”、“曲折前行”和“再度繁榮”四個(gè)階段。
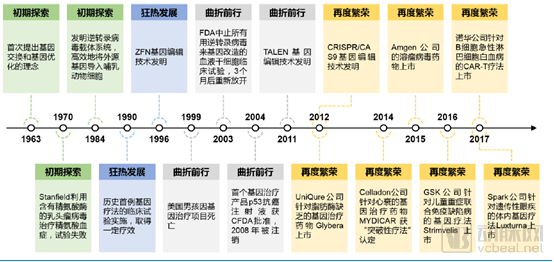
基因治療發(fā)展歷史(來源:華金證券)
目前基因治療有兩種基本策略:第一種使用整合型載體,將基因?qū)肭绑w細(xì)胞或干細(xì)胞基因組,伴隨著細(xì)胞的分裂將插入的基因傳遞至子代細(xì)胞;第二種使用非整合型載體,轉(zhuǎn)入的基因獨(dú)立存在于不具備分裂能力或分裂極慢的宿主細(xì)胞核內(nèi),以實(shí)現(xiàn)相關(guān)基因的持續(xù)表達(dá)。目前針對這兩種治療策略,基因治療的具體治療過程可以分為體外治療和體內(nèi)治療兩類。
體外治療的過程是將患者自體細(xì)胞分離,并在體外轉(zhuǎn)入治療性基因,最后將細(xì)胞輸注回患者體內(nèi)。體外療法一般使用整合型載體,對諸如造血干細(xì)胞等具有持續(xù)分裂能力的細(xì)胞進(jìn)行基因插入。與之對應(yīng)的,體內(nèi)治療則使用非整合性載體,大多通過靜脈注射等與一般藥物類似的給藥方法,更具可操作性。
在具體應(yīng)用上,基因治療技術(shù)主要分為以病毒為載體的基因遞送技術(shù)和基因編輯技術(shù)兩大類。
基因遞送技術(shù)可以采用導(dǎo)入正常基因,以緩解自身有缺陷的相關(guān)基因,或?qū)胫虏』虻囊种菩孕蛄腥纾╥RNA、shRNA等)降低致病基因翻譯或轉(zhuǎn)錄水平等策略。
基因編輯技術(shù)則主要以鋅指核酸酶(zinc finger nuclease, ZFN)、轉(zhuǎn)錄活化因子樣受體核酸酶(transcription activator-like effector nuclease,TALEN)和成簇的規(guī)律間隔短回文序列重復(fù)(clustered regulatory intersoaced short palindromic repeat,CRISPR)-CRISPR相關(guān)蛋白(Cas)三類技術(shù)為代表,可實(shí)現(xiàn)對于目的基因的校正、敲除和增加。
目前對于體外/體內(nèi)兩種治療策略的安全性考慮核心因素有所不同,體外治療側(cè)重基因組整合過程中造成插入突變的風(fēng)險(xiǎn),體內(nèi)療法則關(guān)注病毒輸注所造成的過度免疫反應(yīng)。
除此之外,質(zhì)粒DNA、裸DNA等也可通過非病毒基因遞送方式,諸如顯微注射、基因槍或者脂質(zhì)體、納米顆粒等。但這種方式可使用的組織/細(xì)胞較為局限,目前轉(zhuǎn)染效率較低,相關(guān)載體依然在不斷開發(fā)中。
遺傳病、罕見病治療是基因治療的重要應(yīng)用方向,目前已經(jīng)獲批上市的基因療法多圍繞這兩點(diǎn)展開。但價(jià)格高昂,監(jiān)管有待完善,競爭激烈但適應(yīng)癥有限,基因治療行業(yè)在業(yè)界廣泛關(guān)注的同時(shí)也伴隨爭議。接下來,本文將從罕見病、遺傳病基因治療的相關(guān)進(jìn)展,基因治療相關(guān)政策、行業(yè)規(guī)范及支付體系,競爭格局等三個(gè)方面,帶你了解不一般的基因治療。
基因療法目前的應(yīng)用包括單基因遺傳病、血友病、眼科及部分神經(jīng)退行性疾病,發(fā)病/治療機(jī)制相對明確的多基因遺傳病以及癌癥的治療研究。本文就第一部分治療領(lǐng)域的藥物獲批及臨床試驗(yàn)進(jìn)展情況進(jìn)行了一定的整理和分析。
已經(jīng)獲批的基因治療產(chǎn)品
自2016年以來,歐盟EMA和美國FDA共批準(zhǔn)了6款基因療法產(chǎn)品,其中包括兩款治療B細(xì)胞血液腫瘤的CAR-T細(xì)胞療法以及四款治療嚴(yán)重單基因遺傳病的基因療法。第一款獲得批準(zhǔn)的AAV基因療法為荷蘭uniQure公司的Glybera,于2012年獲得EMA批準(zhǔn),用于治療脂蛋白脂肪酶缺乏癥。但由于其效果有限、定價(jià)太高(平均一次療法100萬美元)且適應(yīng)癥太過罕見(發(fā)病率1/100萬),上市至今僅有一位患者接受治療,Glybera在2017年黯然退市。
2016年5月,EMA批準(zhǔn)了GSK公司的Strimvelis上市,用于治療腺苷酸脫氫酶(ADA)缺失導(dǎo)致的嚴(yán)重聯(lián)合免疫缺陷(SCID)(GSK于2018年4月將包括Strimvelis在內(nèi)的罕見病基因療法管線以19.9%的股權(quán)交換轉(zhuǎn)移至Orchard Therapeutics公司)。
由于免疫系統(tǒng)嚴(yán)重受損,部分ADA-SCID患者會(huì)在嬰幼兒時(shí)期死亡,其他的患者也只能終生生活在無菌環(huán)境中,ADA-SCID也因此被稱為“泡泡男孩病”。在該療法出現(xiàn)之前,患者只能依靠干細(xì)胞移植或酶替代療法控制,酶替代療法需要每周注射,每年價(jià)格40萬美元左右。
Strimvelis是一種體外基因療法,使用γ-逆轉(zhuǎn)錄病毒將正常ADA基因?qū)牖颊逤D34+ HSPCs中。該療法的價(jià)格大約在66萬美元一次,理論上僅需一次治療即可終生獲益。
2017年12月,F(xiàn)DA批準(zhǔn)了Spark Therapeutics公司開發(fā)的Luxturna,用于治療RPE65雙等位基因突變導(dǎo)致的遺傳性視網(wǎng)膜疾病先天性黑朦癥Ⅱ型(Leber’s congenital amaurosis, LCA)。RPE65基因突變導(dǎo)致其蛋白失去異構(gòu)酶活性,引起了11-順-視黃醛的缺乏,從而造成患者體內(nèi)的光感受器細(xì)胞無法感光。到了晚期,11-順-視黃醛的缺乏可能引發(fā)視錐細(xì)胞和視桿細(xì)胞變性,發(fā)生嚴(yán)重的視力喪失。在Luxturna獲批上市前,LCA尚無有效治療藥物。Luxturna使用AAV2攜帶RPE65基因,采用在視網(wǎng)膜下腔直接注射的方法將病毒導(dǎo)入眼球中。該療法的雙眼治療價(jià)格在85萬美元左右。
2019年5月,F(xiàn)DA批準(zhǔn)了諾華公司旗下AveXis Inc.的體內(nèi)基因治療藥物Zolgensma,用于治療SMN1雙等位基因缺陷導(dǎo)致的脊髓型肌肉萎縮(SMA)嬰兒患者(<2歲)。SMA的發(fā)病率約為1/5000-1/12000,表現(xiàn)為進(jìn)行性肌肉無力、癱瘓等癥狀。按照SMN基因拷貝數(shù)以及蛋白表達(dá)水平,SMA嚴(yán)重程度可分為四種亞型,其中I型最為嚴(yán)重,出現(xiàn)癥狀時(shí),嬰兒一般6個(gè)月大,僅有8%的嬰兒能夠生存超過兩歲。在Zolgensma獲批之前,美國藥企Biogen的Spinraza是唯一被批準(zhǔn)治療SMA的療法。與Zolgensma的治療思路不同,Spinraza是一種SMN基因的反義寡核苷酸(ASO),需要通過腰穿鞘內(nèi)注射,每4個(gè)月一次。Spinraza理論上可能需要終生注射,相對應(yīng)的治療價(jià)格為第一年75萬美元,此后每年37.5萬美元。Zolgensma通過靜脈輸注載有SMN功能基因的AAV9載體,實(shí)現(xiàn)對于SMA的根治。該產(chǎn)品官方定價(jià)為212.5萬美金一次治療,被稱為史上單次治療最貴藥物。
然而在FDA批準(zhǔn)上市后的一個(gè)月,Zolgensma的研發(fā)生產(chǎn)公司AveXis主動(dòng)向FDA和其他監(jiān)管機(jī)構(gòu)承認(rèn),這一基因療法在一項(xiàng)動(dòng)物實(shí)驗(yàn)中存在部分?jǐn)?shù)據(jù)操縱的問題。2019年8月6日,F(xiàn)DA啟動(dòng)對于Zolgensma數(shù)據(jù)準(zhǔn)確度的全面審查,截至目前,調(diào)查結(jié)果未顯示該產(chǎn)品在安全性、功效性和質(zhì)量上存在問題。
2019年6月,EMA對藍(lán)鳥生物開發(fā)的藥物Zynteglo進(jìn)行了有條件批準(zhǔn),同意Zynteglo用于治療12歲以上非β0/β0基因型輸血依賴型β-地中海貧血(TDT)患者。TDT是一種遺傳性貧血病,由于編碼β-珠蛋白的基因發(fā)生缺陷或突變,導(dǎo)致β-珠蛋白合成降低而α-珠蛋白過量并以不可溶的包涵體存在于紅細(xì)胞中,誘導(dǎo)紅細(xì)胞凋亡產(chǎn)生貧血癥狀。該病世界范圍內(nèi)發(fā)病率為1/10萬,歐盟區(qū)為萬分之一,而部分地區(qū)發(fā)病率極高(塞浦路斯 14%、撒丁島10.3%)。TDT的常規(guī)療法為長期輸血聯(lián)合貼螯合劑或造血干細(xì)胞移植。
Zynteglo為一種體外基因療法,通過慢病毒載體將功能性人βA-T87Q-珠蛋白基因?qū)隒D34+ HSC中并回輸,使患者能自主生成β-珠蛋白,從而產(chǎn)生足夠的血紅蛋白,減少或消除輸血治療的必要性。此外,藍(lán)鳥生物正在測試Zynteglo在鐮刀型紅細(xì)胞貧血中的療效,計(jì)劃2020年在美國進(jìn)行銷售。該療法的180萬美元一次治療,是僅次于Zolgensma的“第二貴”藥物。
基因治療臨床試驗(yàn)情況分析
截至2019年9月,以lentivirus為載體的體外基因治療臨床試驗(yàn)共有115項(xiàng),以rAAV為載體的體內(nèi)基因治療臨床試驗(yàn)共有190項(xiàng)。以ZFN、TALEN和CRISPR-Cas技術(shù)作為基因編輯工具的臨床試驗(yàn)共32項(xiàng),大部分針對腫瘤的治療。
在罕見病/遺傳病治療領(lǐng)域,有4項(xiàng)研究是使用rAAV作為載體的體內(nèi)基因編輯試驗(yàn),另外5項(xiàng)為體外基因編輯試驗(yàn)(未使用慢病毒作為基因編輯工具的遞送載體)。在正在進(jìn)行中的基因治療臨床試驗(yàn)中,約58%為Ⅱ期研究、33%為Ⅰ期研究,Ⅲ期臨床試驗(yàn)占比大約9%。
目前正在進(jìn)行的以慢病毒為載體的體外基因療法臨床試驗(yàn)共有55項(xiàng),多數(shù)集中于X-連鎖嚴(yán)重聯(lián)合免疫缺陷、鐮刀型紅細(xì)胞貧血、血友病、粘多糖貯積癥(MPS)以及溶酶體貯積癥等遺傳病的治療。部分相關(guān)臨床試驗(yàn)的情況整理如下:
罕見病體外基因療法部分臨床試驗(yàn)整理
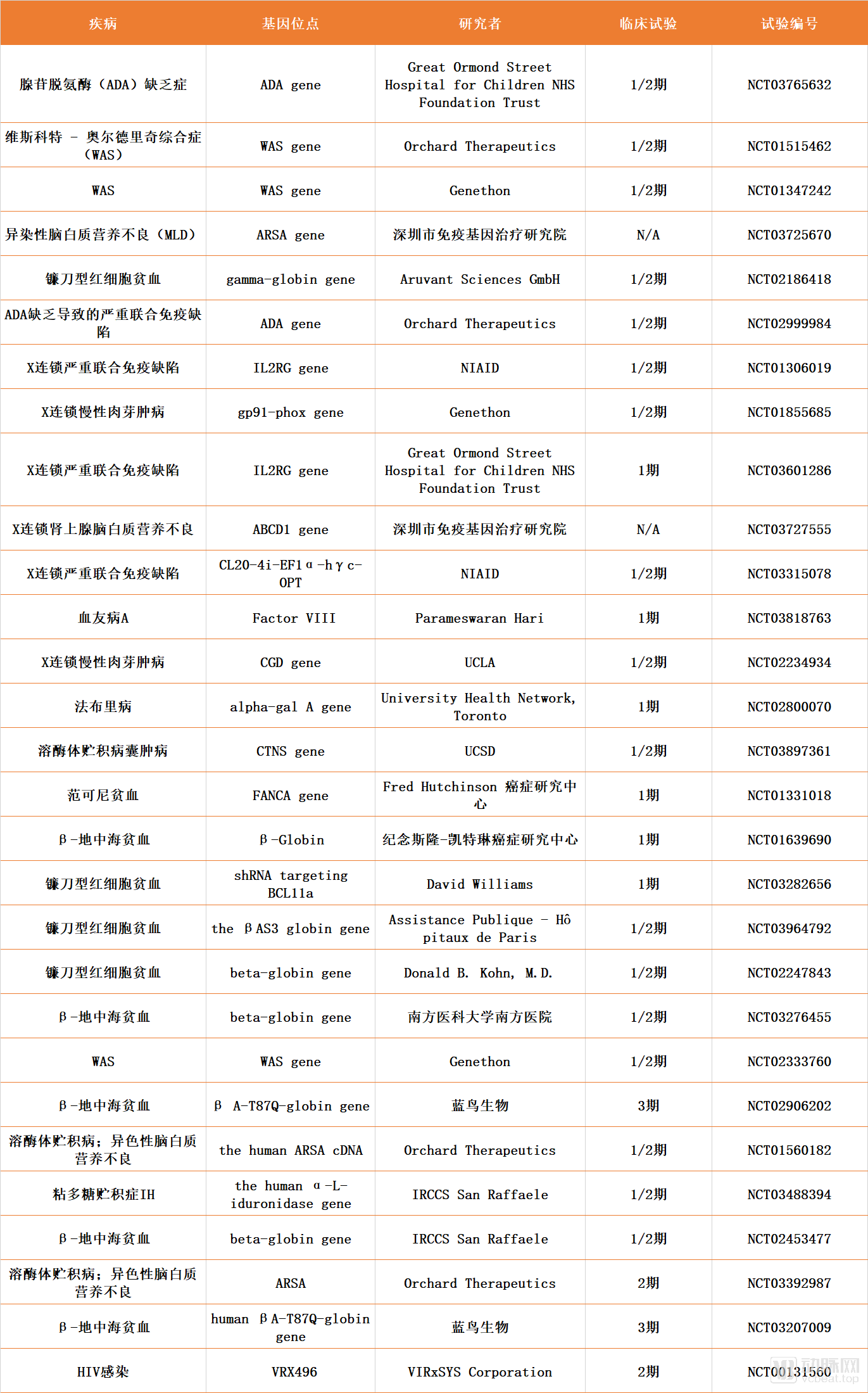
數(shù)據(jù)來源:Clinicaltrials.gov, 探針資本整理
在不同血清型中,研究最為充分的AAV2和AAV8最多地被用于臨床試驗(yàn)。由于rAAV的不同血清型天然存在對于特定組織和器官的靶向性,目前大多數(shù)基于rAAV的基因治療集中于對肝臟、橫紋肌和中樞神經(jīng)系統(tǒng)的特異性靶向。多種天然AAV衣殼蛋白均可傳輸至肝臟,該載體在治療A型血友病、B型血友病、家族性高膽固醇血癥、鳥苷酸轉(zhuǎn)糖化酶缺乏癥和Crigler-Najjar綜合癥中發(fā)揮作用。
AAV8和AAV9可以針對全身多種肌肉類型,用于治療杜氏肌營養(yǎng)不良(DMD),以及運(yùn)用心臟中與某些信號(hào)通路和代謝相關(guān)的特定基因如SERCA2a治療心臟衰竭等。
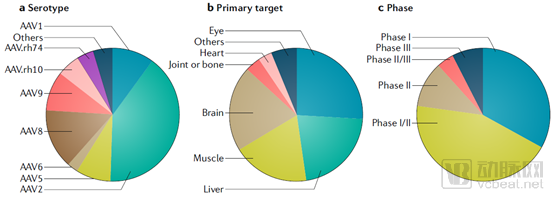
AAV為載體的體內(nèi)基因療法臨床試驗(yàn)統(tǒng)計(jì)(截至2018年11月)(來源:Nature)
從上圖可以看出,臨床開發(fā)中rAAV的基因遞送治療中,很大一部分作用于中樞神經(jīng)系統(tǒng),包括腦以及眼球。眼球是一個(gè)相對分隔的器官,血眼屏障的存在使得rAAV病毒直接眼底注射即可達(dá)到基因遞送的效果,且治療所需病毒載體數(shù)量較少,不會(huì)導(dǎo)致炎癥性免疫反應(yīng),減少了由于抗體中和或免疫反應(yīng)引起的療效降低。
目前針對眼部進(jìn)行基因治療臨床試驗(yàn)的適應(yīng)癥包括先天性黑朦、遺傳性脈絡(luò)膜視網(wǎng)膜營養(yǎng)不良、全色盲和Leber遺傳性視神經(jīng)病變(LHON)。
相比之下,大腦更加復(fù)雜,體積相對較大,因此腦實(shí)質(zhì)直接注射rAAV會(huì)導(dǎo)致rAAV的局部分布。對于如帕金森癥這類致病區(qū)域相對明確的神經(jīng)系統(tǒng)疾病,核殼區(qū)域使用rAAV即為理想治療方法。另外,鞘內(nèi)注射病毒至腦脊液間隙也可獲得更廣泛的中樞神經(jīng)分布,但相對風(fēng)險(xiǎn)較大。AAV9和AAVrh.10可以穿越血腦屏障,因此可用其將基因傳遞至神經(jīng)元和膠質(zhì)細(xì)胞。目前已經(jīng)有研究證明了全身性rAAV治療中樞神經(jīng)系統(tǒng)疾病的療效,包括脊髓型肌萎縮癥(SMA)、肌萎縮側(cè)索硬化癥、卡納文病等適應(yīng)癥。部分rAAV基因遞送臨床試驗(yàn)的情況如下表所示:
部分rAAV基因遞送臨床試驗(yàn)統(tǒng)計(jì)
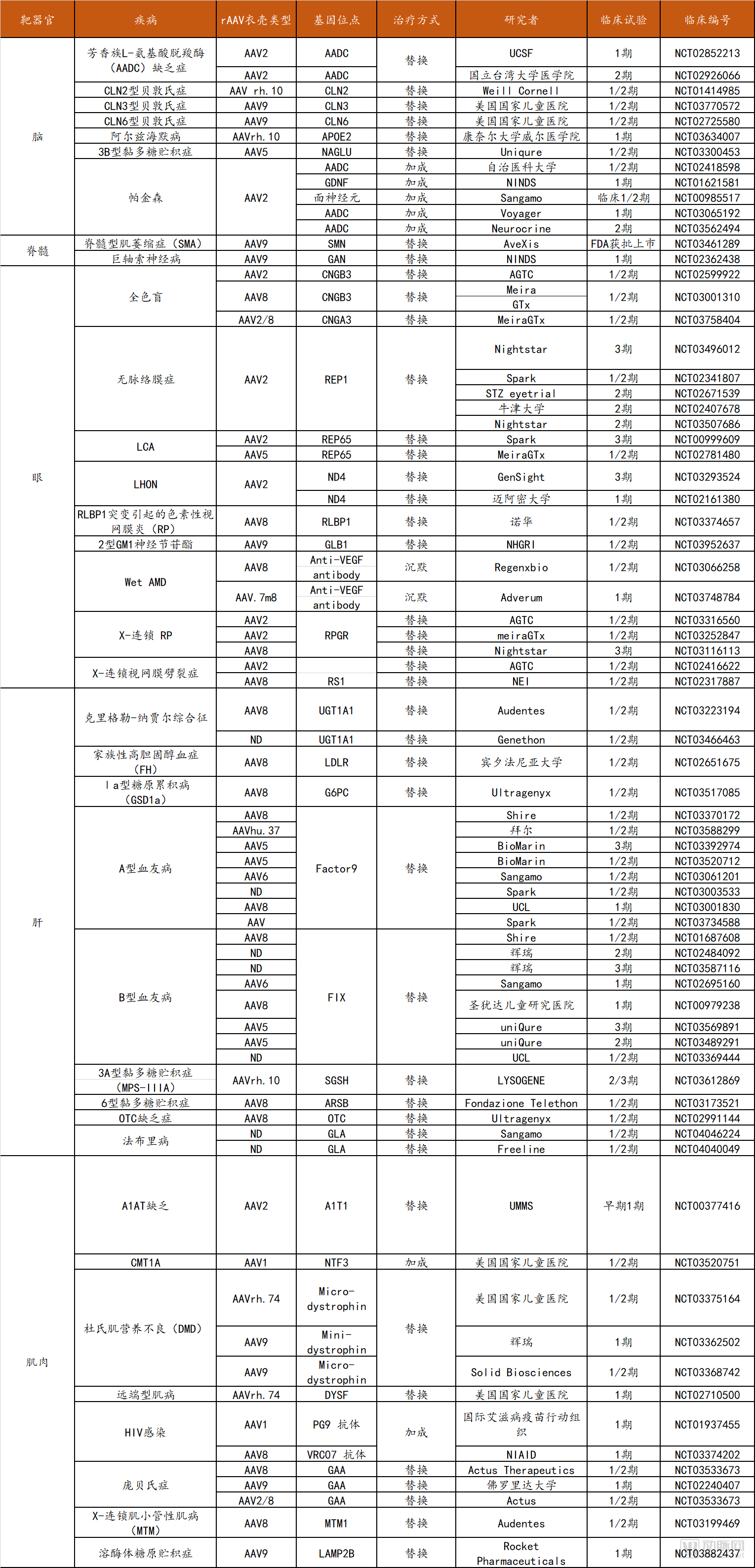
數(shù)據(jù)來源:Clinicaltrials.gov,探針資本
由于基因編輯技術(shù)本身較新,機(jī)制并非完全揭示,脫靶效應(yīng)并非完全可控,出于安全性的考慮,即便在科研領(lǐng)域引起了極大的關(guān)注和廣泛的研究,基因編輯技術(shù)真正在臨床當(dāng)中應(yīng)用仍然相對有限。截至目前,在臨床試驗(yàn)中可查的三種基因編輯技術(shù)分別為ZFN (14項(xiàng)),TALEN( 3項(xiàng)),CRISPR (15項(xiàng)),其中ZFN的大部分臨床試驗(yàn)針對HIV感染(8項(xiàng)試驗(yàn),CCR5作為靶點(diǎn)),TALEN和CRISPR的大部分臨床試驗(yàn)集中在多種癌癥的治療領(lǐng)域(13項(xiàng)),并且中國的臨床試驗(yàn)總數(shù)在全球名列前茅。
在罕見病/遺傳病治療領(lǐng)域方面,ZFN的5項(xiàng)試驗(yàn)全部被Sangamo公司囊括,適應(yīng)癥包括B型血友病、MPS以及地中海貧血和鐮狀細(xì)胞病(與Bioverativ賽諾菲子公司合作進(jìn)行)。CRISPR-Cas9相關(guān)試驗(yàn)共四項(xiàng),3項(xiàng)為針對血液疾病的體外治療,其唯一的體內(nèi)治療研究針對先天性黑朦。
罕見病/遺傳病基因編輯臨床試驗(yàn)匯總
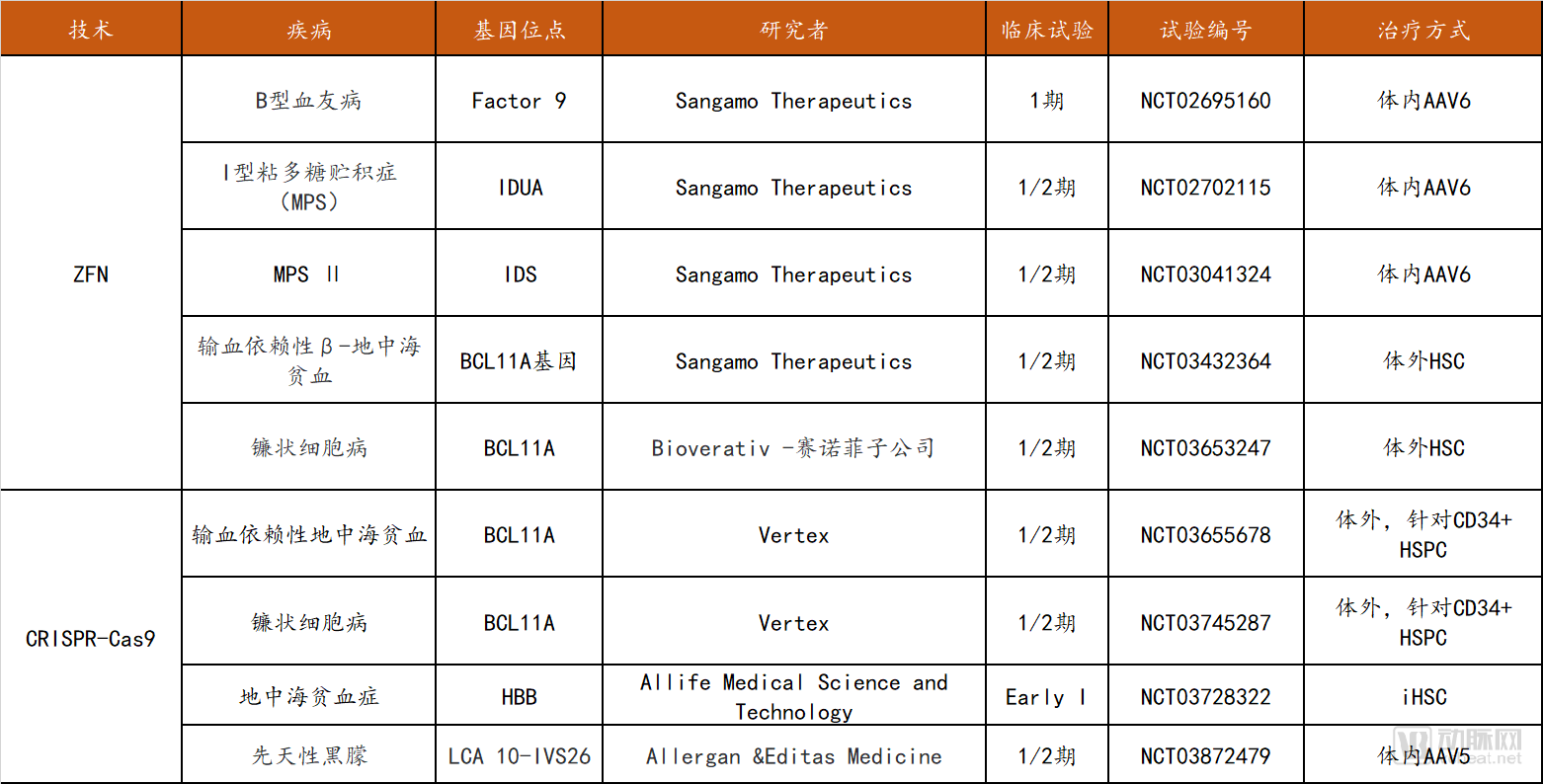
數(shù)據(jù)來源:clinicaltrials.gov,探針資本
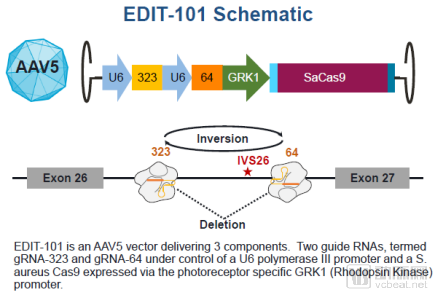
首例CRISPR體內(nèi)基因編輯藥物治療原理(來源:Editas官網(wǎng))
基因治療,尤其是采用基因編輯技術(shù)進(jìn)行的基因治療作為一項(xiàng)新興技術(shù),在世界各個(gè)地區(qū)受到不同政府組織不同程度的監(jiān)管。其中歐美地區(qū)在該領(lǐng)域具有相對嚴(yán)謹(jǐn)和完善的監(jiān)管體系,國內(nèi)法律法規(guī)及監(jiān)管則有待進(jìn)一步的發(fā)展。此外,行業(yè)內(nèi)多個(gè)國際聯(lián)合組織同樣在規(guī)范技術(shù)及其臨床應(yīng)用上發(fā)揮著重要的作用。
具體到罕見病的基因治療方面,目前70%的基因療法都是針對罕見病。美國、歐盟、日本、以及中國等多個(gè)國家和地區(qū)在近些年均出臺(tái)了一系列針對罕見病的利好政策,如稅收抵免、專項(xiàng)基金資助研究、市場獨(dú)占期、加快其注冊審評(píng)審批等。罕見病療法在申報(bào)臨床試驗(yàn)時(shí)還可適當(dāng)?shù)臏p少臨床試驗(yàn)病例數(shù)或者提出免做臨床試驗(yàn)申請。比如Mustang Bio公司和圣猶達(dá)兒童研究醫(yī)院合作開發(fā)的針對X-SCID的MB-107慢病毒載體基因療法就被美國授予再生醫(yī)學(xué)先進(jìn)療法認(rèn)定(RMAT)。RMAT是專門為再生性療法設(shè)立的審評(píng)途徑,與FDA的突破性療法認(rèn)定類似.這一認(rèn)證將加快該療法的開發(fā)和評(píng)審速度。
2017年12月先天性黑朦治療藥物L(fēng)uxturna在美國上市后,我國藥監(jiān)局在2018年11月1日將其列入第一批臨床急需境外新藥公示名單,目前正在通過快速審批通道。由此可以看出,針對罕見病的政策在大幅度傾斜,這也鼓勵(lì)了基因療法針對罕見病治療領(lǐng)域的引進(jìn)、研發(fā)、生產(chǎn)。此外,由于目前上市遺傳病基因治療產(chǎn)品超高的定價(jià),該療法的支付體系亦是多方關(guān)注的熱點(diǎn)。
美國基因治療政策梳理
美國是基因治療方面先驅(qū)者,對基因治療的監(jiān)管體系相對完整。與世界各國的相關(guān)監(jiān)管機(jī)構(gòu)相比,美國傾向于保守和謹(jǐn)慎的態(tài)度。比如歐盟于2012年批準(zhǔn)了第一例基因治療藥物,而FDA直到2017年才批準(zhǔn)第一款基因治療藥物。
早在1974年美國國立衛(wèi)生研究院(National Institutes of Health,NIH)就成立了重組DNA咨詢委員會(huì)(Recombinant DNA Advisory Committee,RAC),其使命從對于使用操縱核酸的新興技術(shù)開展的研究,擴(kuò)大到了涵蓋對人類基因治療方案的審查和討論。1984年,F(xiàn)DA首次對基因治療產(chǎn)品進(jìn)行監(jiān)管,形成了FDA、NIH對基因療法雙監(jiān)管的格局。1990年,F(xiàn)DA開始批準(zhǔn)人類基因療法試驗(yàn)。但1999年基因療法出現(xiàn)了死亡事故,這導(dǎo)致政府加強(qiáng)了對基因治療的審查監(jiān)管力度,F(xiàn)DA和NIH先后公布了基因治療的多項(xiàng)監(jiān)管方法,同時(shí)具體監(jiān)管方式也在不斷發(fā)生改變。
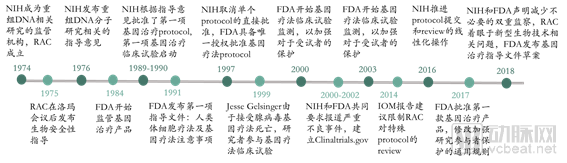
美國對基因治療的監(jiān)管歷史(來源:NEJM,探針資本)
2018年8月,F(xiàn)DA和NIH共同在《NEJM》上發(fā)表文章,聲明并沒有充分的證據(jù)證明基因療法存在特殊的、不可預(yù)知的安全風(fēng)險(xiǎn),不需要不同于其他治療方法的監(jiān)管措施。因此,美國將對現(xiàn)有基因治療的監(jiān)管體系實(shí)施改革,監(jiān)管職能逐步精簡到單一機(jī)構(gòu)FDA,鼓勵(lì)基因療法的開發(fā)。FDA根據(jù)基因治療技術(shù)發(fā)展情況的不斷更新,從產(chǎn)品研發(fā)的各個(gè)環(huán)節(jié)給予企業(yè)指導(dǎo),目前共發(fā)布了12個(gè)指南,涉及七個(gè)方面。
FDA關(guān)于基因治療的相關(guān)法規(guī)
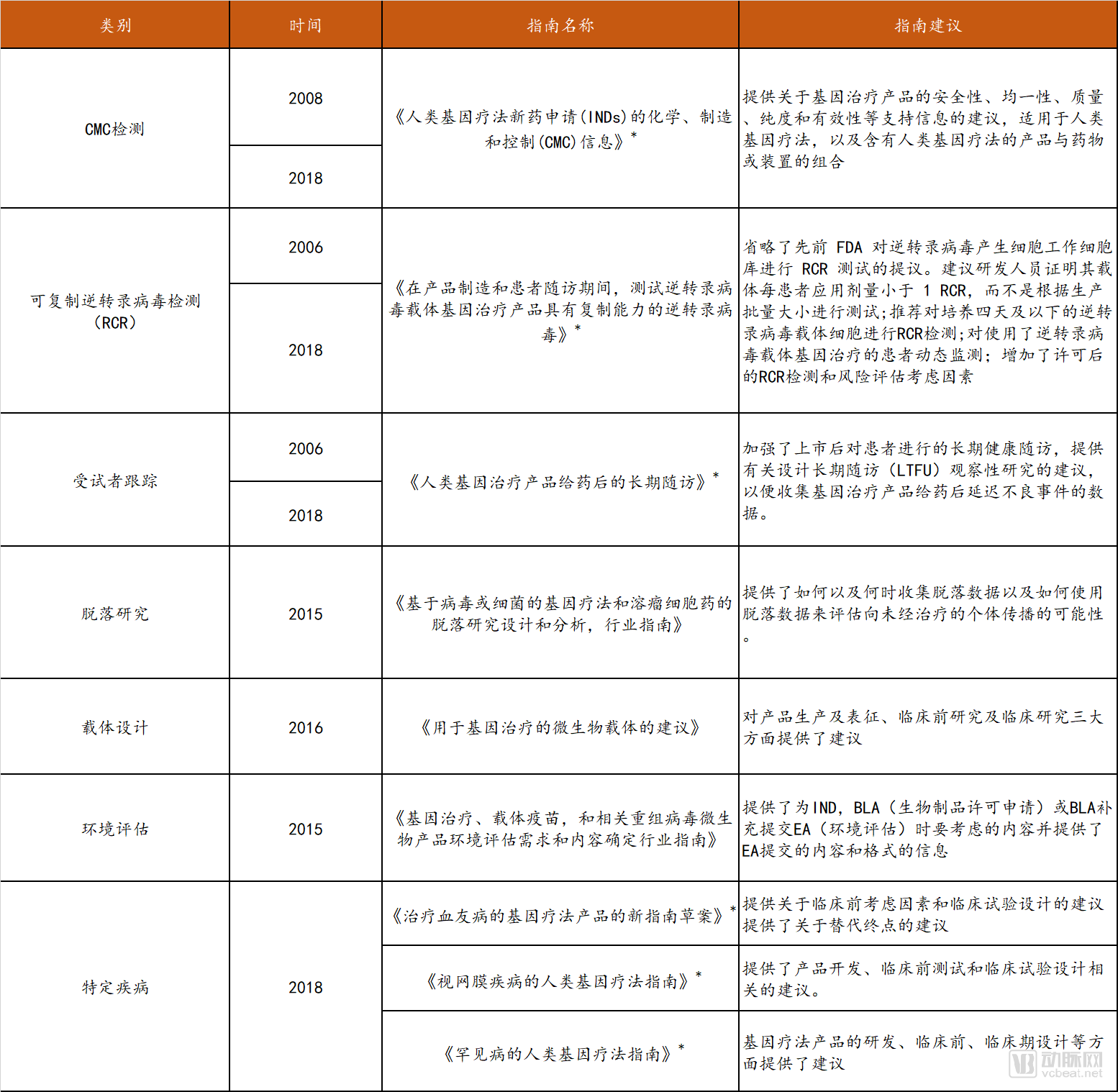
* 代表草案
數(shù)據(jù)來源: FDA官網(wǎng),探針資本整理
以2018年發(fā)布的《罕見病的人類基因療法指南》(草案)為例,該指南旨在幫助申辦者設(shè)計(jì)臨床開發(fā)計(jì)劃,就其可能存在有限的研究人群、規(guī)模,潛在的可行性和安全性問題,以及與解釋有效性的問題給出了建議。
國內(nèi)基因治療政策梳理
在基因治療領(lǐng)域,我國在基礎(chǔ)研究和臨床試驗(yàn)開展相對較早,1991年便進(jìn)行了2例逆轉(zhuǎn)錄病毒體外治療B型血友病的臨床試驗(yàn)。然而與之對應(yīng)的是長久以來政策法規(guī)相對落后、內(nèi)容也相對簡單,對其研究過程中涉及到的具體問題未有詳細(xì)的說明和規(guī)定,法規(guī)約束性不強(qiáng)。早期,國內(nèi)在此類產(chǎn)品的審批上相對松懈,比如2003年一款名為“今又生”的針對頭頸部腫瘤P53基因抗癌藥物,在臨床試驗(yàn)僅有100余例樣本且沒有標(biāo)準(zhǔn)Ⅲ期臨床試驗(yàn)數(shù)據(jù)的情況下,就被獲批上市,宣稱“全球首例獲批上市的基因治療藥物”;此外還有2018年底讓全球?yàn)橹痼@的“世界首例基因編輯嬰兒”事件,也嚴(yán)重?fù)p害了中國科技界及相關(guān)政府機(jī)構(gòu)的形象和利益。
在這樣的背景下,2019年起,相關(guān)政府機(jī)構(gòu)開始不斷加強(qiáng)對于基因治療領(lǐng)域的監(jiān)管:
2019年4月發(fā)布的《民法典人格權(quán)編(草案二次審議稿)》增加規(guī)定:從事與人體基因、人體胚胎等有關(guān)的醫(yī)學(xué)和科研活動(dòng)的,應(yīng)當(dāng)遵守法律、行政法規(guī)和國家有關(guān)規(guī)定,不得危害人體健康,不得違背倫理道德。在8月22日提交的人格權(quán)編草案三審稿中進(jìn)一步增加規(guī)定:從事此類活動(dòng)“不得損害公共利益”。2019年5月發(fā)布《中華人民共和國人類資源遺傳管理?xiàng)l例》,在基因編輯方面根據(jù)最新形勢變化做出了相應(yīng)的修改和完善。
國家藥典委2017年立項(xiàng),參考FDA、美國藥典等對于基因治療制品的要求,于2019年6月公布了《人用基因治療制品總論(公示稿)》,對通用的技術(shù)提出了要求,為保障制品的安全性、有效性奠定良好基礎(chǔ),也將推動(dòng)此類技術(shù)制品的產(chǎn)業(yè)化進(jìn)程和臨床應(yīng)用。此外,國務(wù)院表示,為了進(jìn)一步加強(qiáng)對包括“基因編輯”在內(nèi)的生命科學(xué)研究、醫(yī)療活動(dòng)的規(guī)范和監(jiān)管,2019年還將加快生物技術(shù)研究開發(fā)安全管理和生物醫(yī)學(xué)新技術(shù)臨床應(yīng)用管理方面的立法工作,以形成相關(guān)領(lǐng)域的全過程監(jiān)管鏈條。相信基因療法的相關(guān)技術(shù)在未來將會(huì)以更嚴(yán)謹(jǐn)?shù)姆绞皆趪鴥?nèi)發(fā)展。目前國內(nèi)涉及基因療法的相關(guān)部分法律法規(guī)整理如下。
國內(nèi)基因治療相關(guān)部分法規(guī)
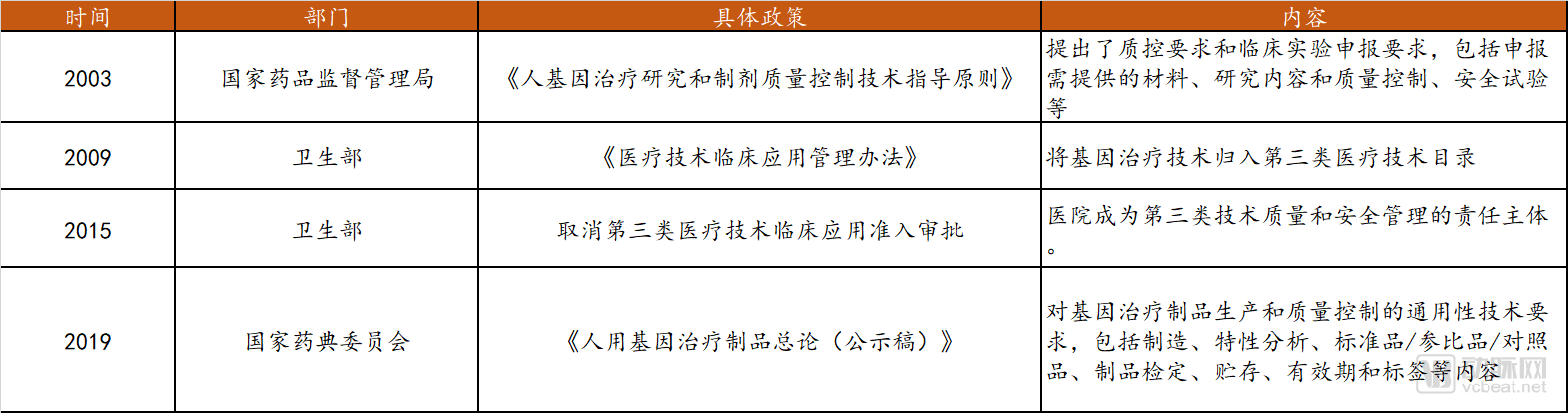
數(shù)據(jù)來源:公開資料,探針資本整理
基因治療相關(guān)行業(yè)規(guī)范
除了相關(guān)政府部門的監(jiān)管和指導(dǎo)之外,針對基因治療這一新型療法,國際上同樣存在相關(guān)的行業(yè)聯(lián)合會(huì),比如NIST基因編輯協(xié)會(huì)、國際標(biāo)準(zhǔn)化組織ISO以及再生醫(yī)學(xué)聯(lián)盟(ARM)等。聯(lián)合會(huì)在科學(xué)家和相關(guān)企業(yè)的呼吁下,為基因治療制定生物倫理國際框架。
ARM是細(xì)胞和基因治療以及更廣泛的再生醫(yī)學(xué)領(lǐng)域國際倡導(dǎo)組織,近期主導(dǎo)開發(fā)了基因治療開發(fā)人員原則聲明。《原則聲明》明確了使用基因編輯技術(shù)的五項(xiàng)關(guān)鍵原則,包括認(rèn)可體細(xì)胞基因編輯的治療應(yīng)用研究,支持使用基因編輯標(biāo)準(zhǔn)以促進(jìn)安全有效的基因編輯療法;呼吁繼續(xù)發(fā)展個(gè)國家和區(qū)域調(diào)控框架,以指導(dǎo)體細(xì)胞基因編輯技術(shù)的發(fā)展;暫停生殖系基因編輯目前在人體臨床環(huán)境中的使用以及除非有關(guān)生殖系基因編輯的倫理和潛在安全問題得到充分解決,否則不支持或?qū)捤∩诚祷蚓庉嬘糜谌祟惻R床試驗(yàn)或人類植入的共同承諾。該聲明由13個(gè)使用基因編輯技術(shù)的共同簽署,包括已有基因治療產(chǎn)品上市的藍(lán)鳥生物,華人科學(xué)家張鋒創(chuàng)立的Editas Medicine以及ZFN技術(shù)壟斷巨頭Sangamo Therapeutics等知名企業(yè)。
支付體系
幾款針對遺傳病開發(fā)的基因治療藥物陸續(xù)獲批上市,其單次治療所需的費(fèi)用不斷刷新著人們的認(rèn)知。史上最貴藥物榜單的前三名都被基因治療藥物所占據(jù):最貴藥物為諾華旗下Zolgensma,單次費(fèi)用212.5萬美元;第二是藍(lán)鳥生物Zynteglo,單次180萬美元;第三是Spark Therapeutics旗下Luxturna,單次85萬美元雙眼。
雖然隨著相關(guān)藥物的進(jìn)一步獲批,在打破寡頭的市場獨(dú)占性后會(huì)迫使寡頭降價(jià),但基因治療藥物本身在研發(fā)、制造工藝以及用藥后對患者進(jìn)行持續(xù)監(jiān)測上的成本都決定了該療法的價(jià)格在短期內(nèi)仍保持在高位。因此如何支付這類價(jià)格高昂的藥物,仍是一個(gè)難題。
現(xiàn)階段采取的方式包括支付方和藥企共同協(xié)商,藥企提出了分期付款、延長付款、按療效付費(fèi)等創(chuàng)新付費(fèi)方式。
比如藍(lán)鳥生物表示Zynteglo的全款可以在五年分期,每年支付約357567美元,患者在開始治療的時(shí)候先支付20%的一次性基因治療費(fèi)用,另外80%將取決于治療成功率。諾華同時(shí)在與保險(xiǎn)公司達(dá)成“基于結(jié)果的協(xié)議”,商討五年時(shí)間內(nèi)的支付模式。
諾華和藍(lán)鳥等基因療法藥企提供了基于價(jià)值的定向選擇,即藥物在起效或分階段幾年后才接受全價(jià)。但目前美國的醫(yī)療補(bǔ)助和醫(yī)療保險(xiǎn)制度并非為這些新方案而設(shè)立,患者在接受基因治療后的支付問題上,依然會(huì)遇到多種挑戰(zhàn)。
因此,罕見病基因療法的支付改革急需進(jìn)行。我們對目前上市的部分罕見病基因治療藥物的支付方式、政策以及限制進(jìn)行了梳理,詳見下表。
罕見病基因藥物支付情況梳理
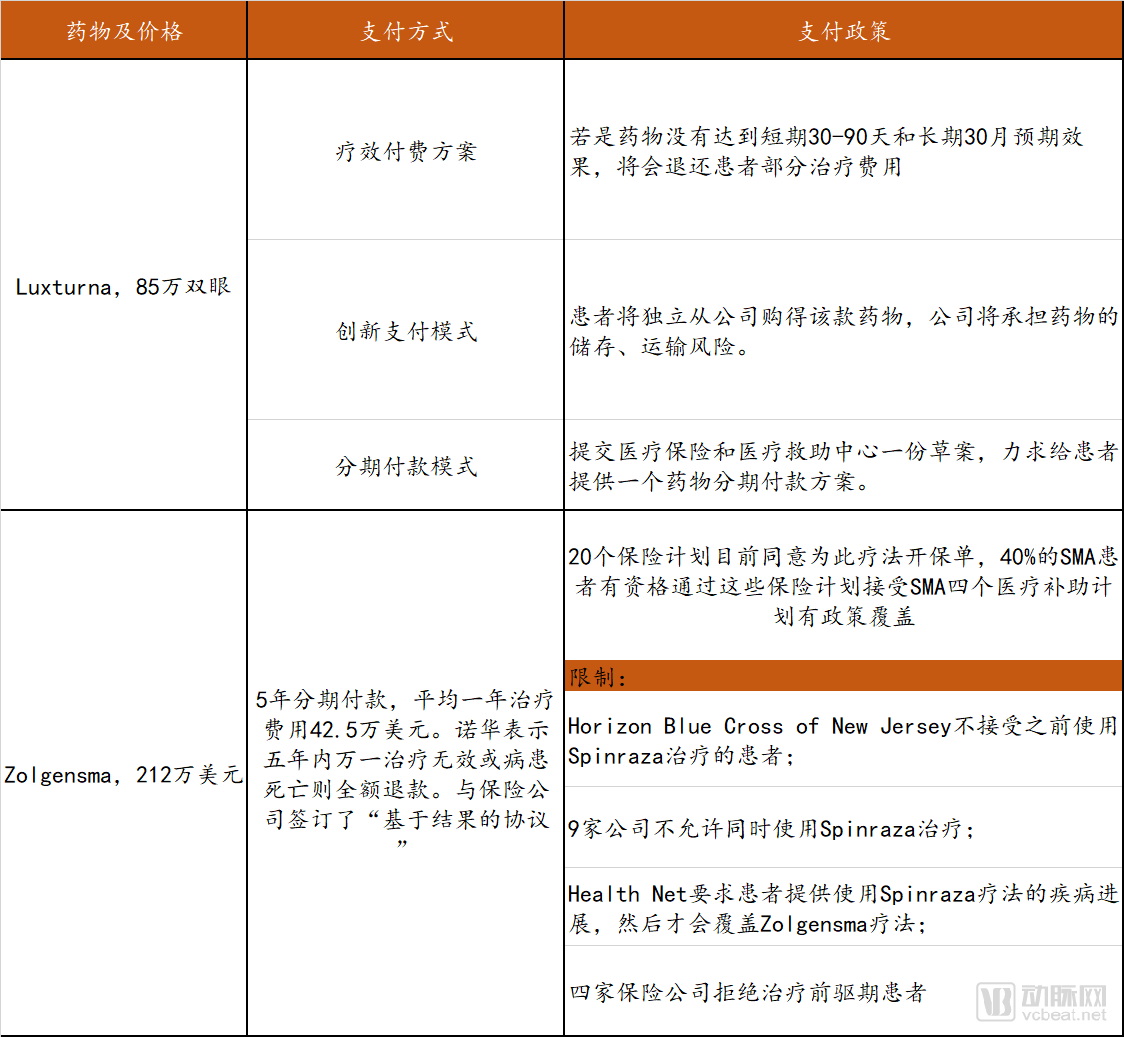
數(shù)據(jù)來源:FiercePharma、探針資本整理
參考各國罕見病保障體系,美國采取以商業(yè)保險(xiǎn)為主、政府醫(yī)療保健計(jì)劃為補(bǔ)充的形式進(jìn)行補(bǔ)助。患者可以通過商業(yè)保險(xiǎn)公司或者藥品保險(xiǎn)經(jīng)營者自愿參加處方藥計(jì)劃,根據(jù)藥品目錄下不同的層次、不同層級(jí)的藥品共付數(shù)額及報(bào)銷情況靈活選擇。其他國家罕見病的醫(yī)療保障體系如下圖所示。考慮到罕見病基因療法能夠達(dá)到的“一次治療、終生治愈”的潛在療效,在相關(guān)療法價(jià)格進(jìn)一步下降的前提下,相比于傳統(tǒng)療法,基因治療給社會(huì)帶來的總的經(jīng)濟(jì)負(fù)擔(dān)有可能反而減小。因此,這里并不排除國家政府或醫(yī)療補(bǔ)助項(xiàng)目在這一領(lǐng)域給予資金支持的可能性。
綜上,我們推測,罕見病基因療法的支付方式,或許會(huì)從現(xiàn)有的按時(shí)間收費(fèi)、按療效收費(fèi)、保險(xiǎn)公司付費(fèi)發(fā)展為多支付主體、多支付手段相結(jié)合的方式。
我國的罕見病的保障體系與上述國家相比較為單一,主要是通過醫(yī)保報(bào)銷。國內(nèi)涵蓋罕見病的商業(yè)保險(xiǎn)產(chǎn)品較少,相關(guān)保險(xiǎn)保費(fèi)較高、賠付條件較為苛刻。我國一些省市地區(qū)(如上海、青島、浙江)正在探索并出臺(tái)具有地方特色的罕見病藥物保障模式。總的來看,加強(qiáng)醫(yī)保談判爭取罕見病基因治療藥物進(jìn)入醫(yī)保目錄,并建立多方參與、多方籌資的支付體系是我國未來罕見病基因療法保障體系的發(fā)展方向。
來源:動(dòng)脈網(wǎng)
主要參考文獻(xiàn)
1. Wang D, Tai PWL, Gao G. Nat Rev Drug Discov. 2019 May;18(5):358-378.
2. Anguela XM, High KA. Annu Rev Med. 2019 Jan 27;70:273-288.
3. High KA, Roncarolo MG. N Engl J Med. 2019 Aug 1;381(5):455-464.
4. Gaj T, Gersbach CA, Barbas CF 3rd. Trends Biotechnol. 2013 Jul;31(7):397-405.
5.Dunbar CE, High KA, Joung JK, Kohn DB, Ozawa K, Sadelain M. Science. 2018 Jan 12;359(6372).
6. Miller JC, Patil DP, Xia DF, Paine CB, Fauser F, Richards HW, Shivak DA, Benda?a YR, Hinkley SJ, Scarlott NA, Lam SC, Reik A, Zhou Y, Paschon DE, Li P, Wangzor T, Lee G, Zhang L, Rebar EJ. Nat Biotechnol. 2019 Aug;37(8):945-952.
7. Paschon DE, Lussier S, Wangzor T, Xia DF, Li PW, Hinkley SJ, Scarlott NA, Lam SC, Waite AJ, Truong LN, Gandhi N, Kadam BN, Patil DP, Shivak DA, Lee GK, Holmes MC, Zhang L, Miller JC, Rebar EJ. Nat Commun. 2019 Mar 8;10(1):1133
8. Miller JC, Tan S, Qiao G, Barlow KA, Wang J, Xia DF, Meng X, Paschon DE, Leung E, Hinkley SJ, Dulay GP, Hua KL, Ankoudinova I, Cost GJ, Urnov FD, Zhang HS, Holmes MC, Zhang L, Gregory PD, Rebar EJ. Nat Biotechnol. 2011 Feb;29(2):143-8
9. Wang H, La Russa M, Qi LS. Annu Rev Biochem. 2016 Jun 2;85:227-64.
10. Fellmann C, Gowen BG, Lin PC, Doudna JA, Corn JE. Nat Rev Drug Discov. 2017 Feb;16(2):89-100
11. Gammage PA, Viscomi C, Simard ML, Costa ASH, Gaude E, Powell CA, Van Haute L, McCann BJ, Rebelo-Guiomar P, Cerutti R, Zhang L, Rebar EJ, Zeviani M, Frezza C, Stewart JB, Minczuk M. Nat Med. 2018 Nov;24(11):1691-1695
12. Bacman SR, Kauppila JHK, Pereira CV, Nissanka N, Miranda M, Pinto M, Williams SL, Larsson NG, Stewart JB, Moraes CT. Nat Med. 2018 Nov;24(11):1696-1700
本文為本網(wǎng)轉(zhuǎn)載,出于傳遞更多信息之目的,并不意味著贊同其觀點(diǎn)或證實(shí)其內(nèi)容的真實(shí)性,如涉及侵權(quán),請權(quán)利人與本站聯(lián)系,本站經(jīng)核實(shí)后予以修改或刪除。
請完善以下信息,我們的顧問會(huì)在1個(gè)工作日內(nèi)與您聯(lián)系,為您安排產(chǎn)品定制服務(wù)
評(píng)論